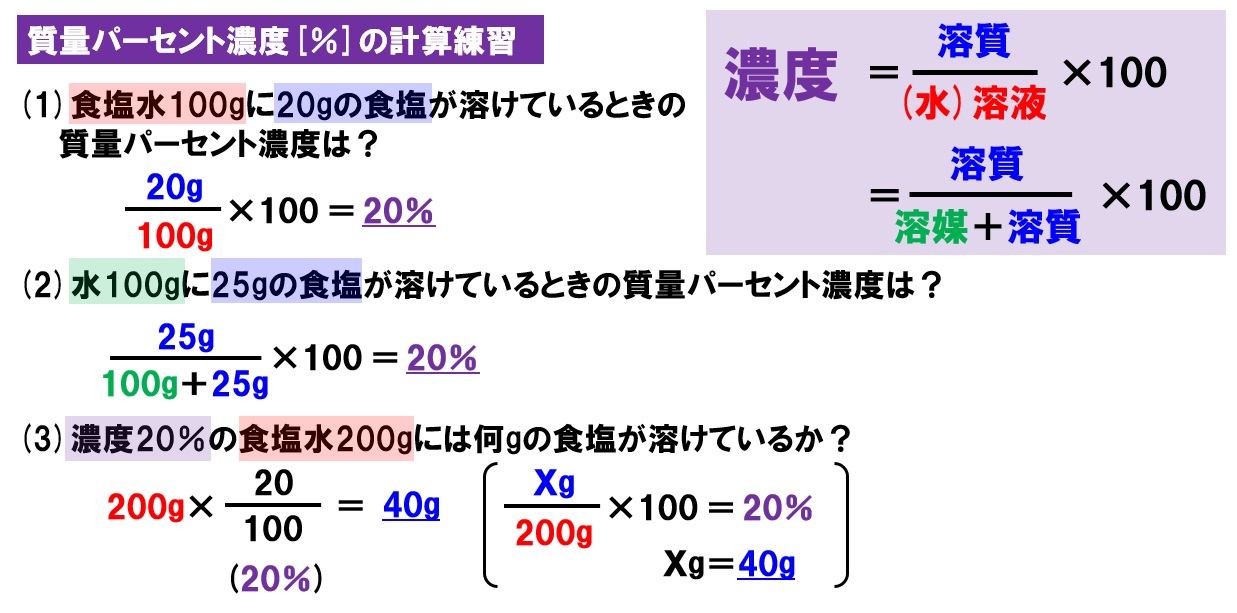
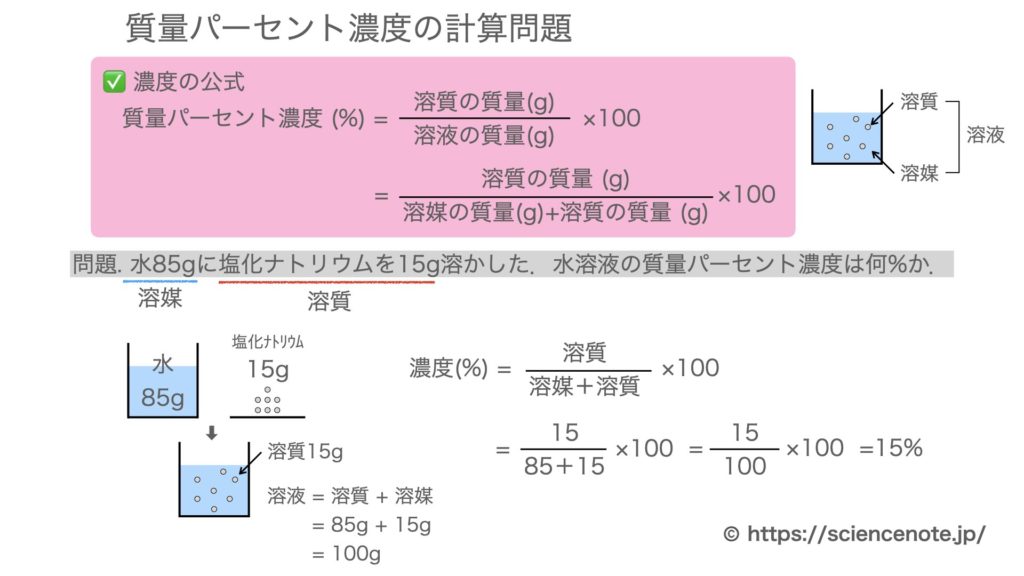
Nov , 18 · 質量パーセント濃度の求め方練習問題 水100gに食塩を25g溶かした水溶液の質量パーセント濃度を求めよ。 答えはこちら 水100gと食塩25gを混ぜるのだから、完成した食塩水は となります。 よって、溶液125g、溶質25gとなるから 水340gに塩を60g溶かした緩衝液の水素イオン濃度は、元になった水溶液の濃度と電離定数から求められる すべての授業の「要点まとめノート」「問題・解答」をPDF無料ダウンロードできる 学校で使っている教科書にあわせて勉強できる わからないところを質問できる 会員登録PHの求め方 pH は水素イオン濃度の log をとって、マイナスにした値である。水素イオン濃度は Cα だから次のように求める。 参考 指数法則と対数法則 底の変換公式の証明 強酸と強塩基の pH の求め方(塩酸、硫酸、水酸化ナトリウム水溶液の pH) 高校化学

3分でわかる 質量パーセント濃度の求め方の計算公式 Qikeru 学びを楽しくわかりやすく
水溶液 濃度 求め方
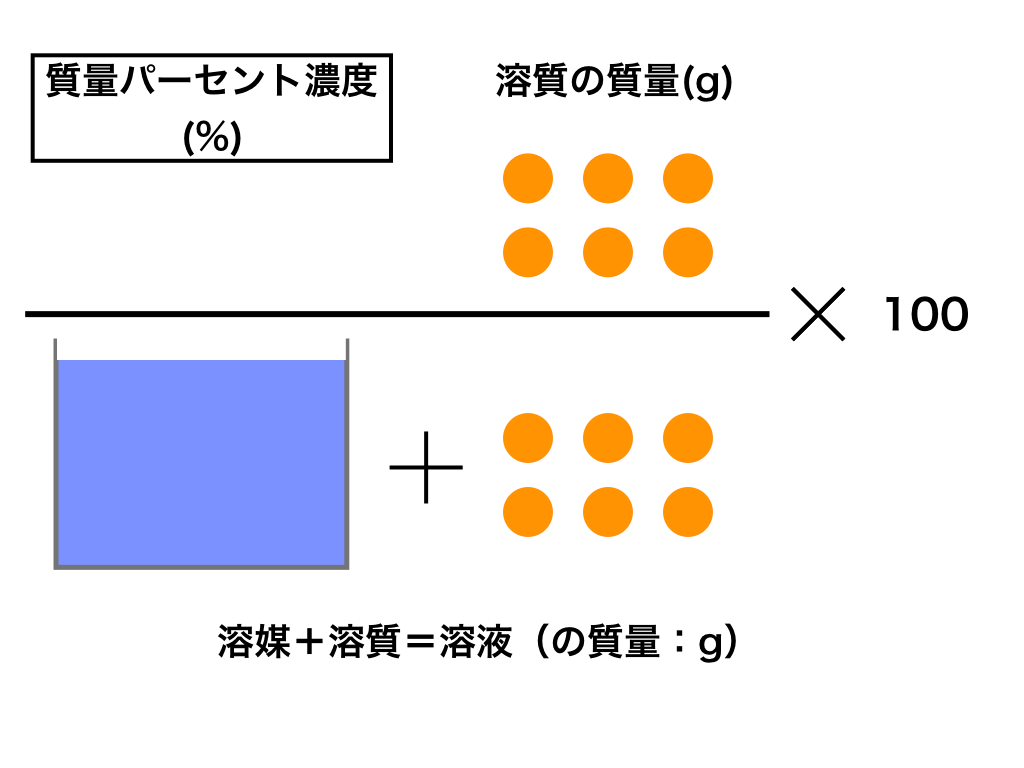
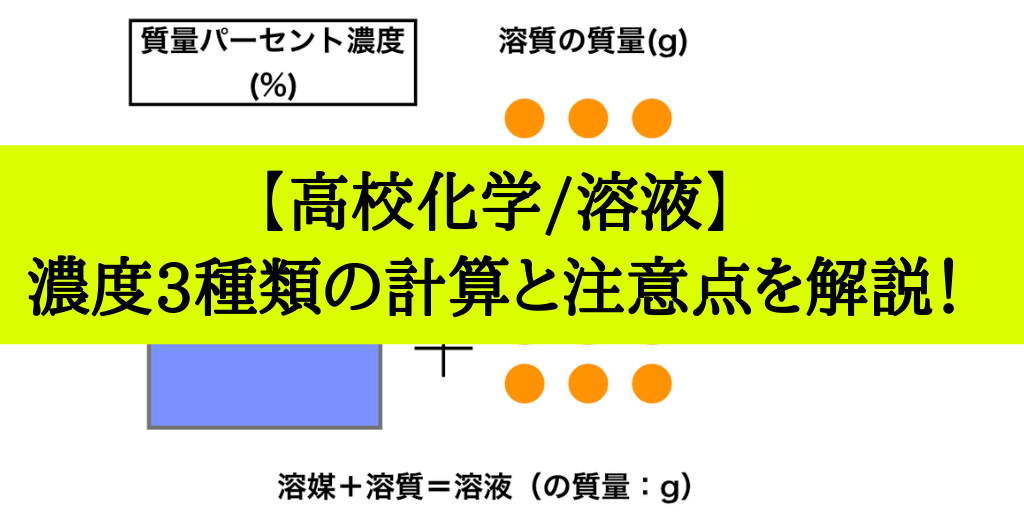
水溶液 濃度 求め方-溶液 = 溶媒 溶質 なので 質量パーセント濃度 = 溶質 (g) 溶質 (g) 溶媒 (g) ×100 濃度を求めるときに分母は溶液である。 水は溶媒なので、分母は砂糖水全体の質量になる。 例水80gに砂糖gを溶かして砂糖水をつくる。 この砂糖水の質量パーセント濃度を求める。 質量パーセント濃度 = 溶質 (g) 溶質 (g) 溶媒 (g) ×100 なので 式 質量パーセント濃度 =質量/体積(容積)パーセント濃度の求め方 溶質の質量 (g) ÷ 溶液の体積・容積 (ml) × 100 = 質量/体積パーセント濃度 % 体積(容積)ml にしめる、溶質の割合を求める方法です。 質量パーセント濃度は、溶液 100g に占める溶質の割合を求める方法ですが



中1理科 水溶液と濃度 水溶液の性質と濃度計算 Pikuu
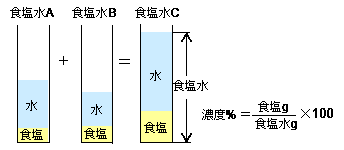
それは、水溶液の濃度に関する公式です。 水溶液の濃度の公式 ここでは分かりやすいように、水溶液を食塩水とします。 食塩水の濃度というと、 「食塩水に含まれる食塩の割合」 を指します。なので、 『食塩水の濃度(%)=食塩の量(g)÷食塩水の量(g)×100』 です。Dec 03, · 優雅 水溶液 濃度 求め 方 食塩水の問題とは 濃度の計算公式や連立方程式を用いた解き方を解説 濃度の求め方 絵で覚えよう Youtube 3分でわかる 質量パーセント濃度の求め方の計算公式 Qikeru 学びを 3分でわかる 質量パーセント濃度の求め方の計算公式水溶液 濃度 求め 方5百万分率濃度(ppm) 定義・説明 ppm parts per millionの略。百万分率。 を1単位として割合をみる場合の「単位」と考えてもよい。 1ppm= =104 % 溶液の濃度をppmで表す場合は、 ppm= 希薄水溶液では、密度を1 g/ml として溶液の質量を求める。 例題5
Oct 23, 09 · アンモニアとアンモニウムイオンではpKaが違いますよね。 アンモニアでは475、アンモニウムイオンでは925です。 アンモニア水溶液を希釈、計算して決まったpHの水溶液を作りたいのですが、どちらのAug 05, · はじめにモル(mol)計算に続く化学の難所として、濃度の変換があります。質量パーセント濃度からモル濃度を求める(その逆も)といった計算問題、苦手としている人も多いのではないのでしょうか。何をどう計算したらよいのかわからず、公式に代入する、とApr 30, · 水和物水溶液のモル濃度の問題が分かりません。 わかる方は回答をお願いします。 ちなみに高1の問題です。 硫酸銅(Ⅱ)五水和物CUSO4・5H2O 125gに水を加えて、500gの硫酸銅(Ⅱ)水溶液を作った。この水溶液のモル濃度は何mol/Lか。
Oct 16, 18 · 質量パーセント濃度とは 質量パーセント濃度とは、溶質の質量 gを溶液全体の質量 gで割って100をかけたものです。この値を上の式にあてはめて計算するとモル濃度がわかります。 1114 g/mL x 1,000mL x 100w/w%/100 ÷ 7813 = 1426mol/L このように濃度を求めるには「比重 (または密度)」「純度 (または含量)」「分子量」の3点がわからなければなりません。水溶液の濃度(質量パーセント濃度):公式と求め方 The さっきの公式の、 濃度 % = 食塩の重さ g ÷ 食塩水の重さ g × 10 質量パーセント濃度 簡単な公式で覚えよう /おときち副塾長 電脳空間学習塾かもん




質量パーセント濃度の求め方 問題を使ってかんたんに解説するぞ 中学数学 理科の学習まとめサイト




見にくくてすいません 化学の質量パーセント濃度計算で Clear
水素イオン濃度 H+=酸の価数×酸のモル濃度×酸の電離度から 水素イオン濃度 H+=1×001×1=001=100gの塩化ナトリウム水溶液になる。 このとき 溶質10g, 溶液(溶媒溶質)100gなので 濃度は 10 100 ×100=10(%) 塩化ナトリウム 100g 90g 10g 水 塩化ナトリウム水溶液 例 100gの水に25gの砂糖を溶かしたときの質量パーセント濃度を求めよ。 答 % 濃度6%の硝酸カリウムこの水溶液のモル濃度を求めましょう。 ただし、原子量 H=10 O=16 Na=23 とします。 (1) まず質量パーセント濃度 (%)から溶質 (g)と溶液 (g) を求めましょう。 質量パーセント濃度 (%)= 溶質の質量(g)÷ 溶液(溶質溶媒)の質量(g)×100なので、15 (%)の水酸化ナトリウム溶液は溶液100g中に15gの水酸化ナトリウム(溶質)が溶けていることになります。 今、簡単に溶液




中1理科 濃度の計算特訓 混ぜ合わせの濃度計算まで Pikuu




中1理科 水溶液の濃度の求め方 食塩水 Youtube
Jan 02, · 2つの水溶液の食塩の質量が求められました。では混ぜた水溶液の数字を、公式にあてはめてやりましょう。 食塩の質量と、合計の食塩水の質量を足して求めれば、あとはいつも通りの計算。 食塩水の濃度は、 % になりましたね。(2) 質量パーセント濃度が3%(w/w)の塩化ナトリウム水溶液500 gを調製す るために必要な塩化ナトリウムの質量は何gか計算せよ. (3) 10 %(w/w)の塩化ナトリウム水溶液を水で希釈して,2 %(w/w)の塩化ナト リウム水溶液500 gを調製したい.このとき必要となる10 %(w/w)塩化ナJul 09, 19 · 濃度(%)=溶質の質量(g)÷ 溶液の質量(g)×100 $$濃度(%) = \frac{ 溶質の質量(g)}{溶液の質量(g)}×100$$ この式は濃度の求め方の基本ですのでしっかり覚えましょう。 飽



モル濃度と密度 質量パーセント濃度の考え方 Vicolla Magazine




中1 理科 化学 濃度の計算方法 14分 Youtube
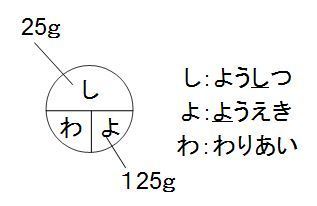
先ほどの濃度を求める式に、 具体的な言葉(=しお)を入れると、 楽な書き方になるんです。 質量パーセント濃度(%) しお (g) しお水 (g) しお(g) しお(g)+水(g) ほら、すごく楽になりまもう1つ、pHの求め方があります。 それが下記のものです。 水素イオン濃度 H+=酸の価数×酸のモル濃度×酸の電離度 水酸化物イオン濃度 OH-=塩基の価数×塩基のモル濃度×塩基の電離度 この式を使えば水素イオン濃度や水酸化物イオン濃度がわかります。 水素イオン濃度は必ず という数値になり、 このnの値がpH になります。 問題で与えられた数値によっページ 3 / 4 よぉ、桜木建二だ。「濃度の計算」って苦手な人が多いよな。 色々な要素を一つの式にまとめると混乱して間違えやすいが、単位を明記して、一つ一つ順序を守って計算していけば間違えることはないんだ。 今回は「濃度の計算」について、実務でも濃度の計算をしてきた




モル濃度計算の解き方 公式 希釈時の濃度 密度や質量パーセント濃度との変換など 化学のグルメ




水 酸化 ナトリウム 分子量 ナトリウム Amp Petmd Com
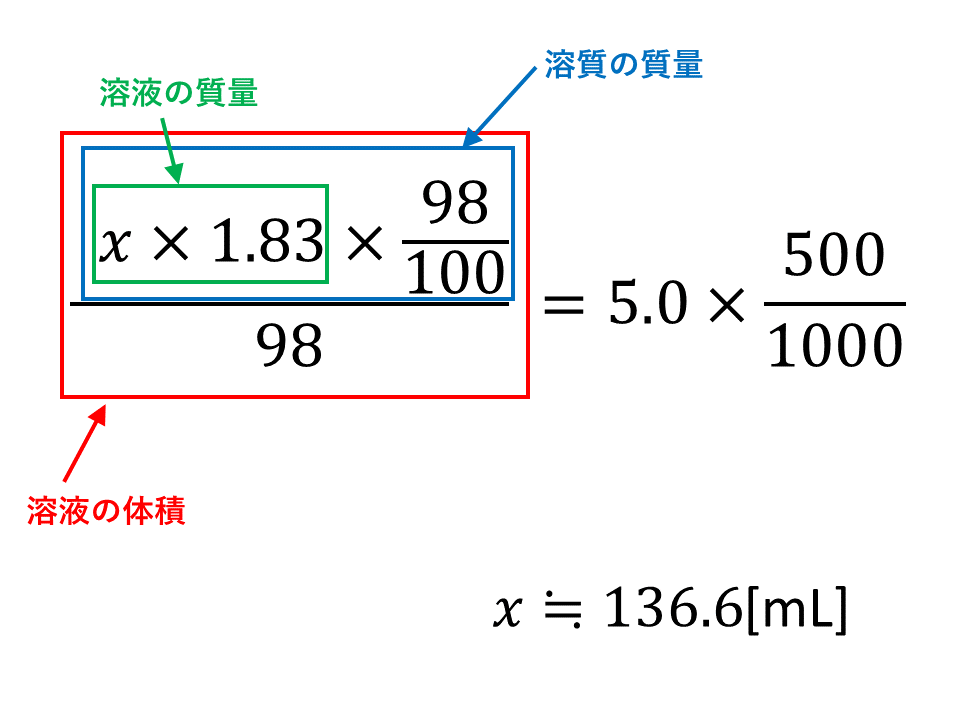
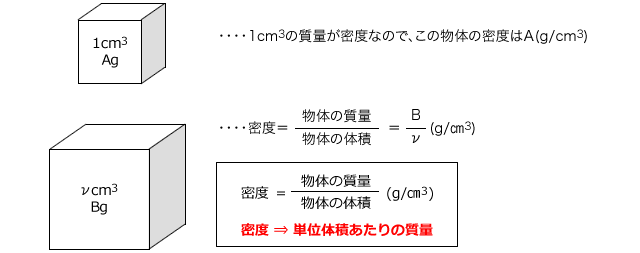
Nov 09, 18 · 040mol/L 硫酸(分子量98)の水溶液の密度は105 g/cm 3 である。この硫酸水溶液の質量パーセント濃度は何%か。 考え方 求めたいのは硫酸水溶液の質量パーセント濃度だから、溶質のグラムと溶液のグラムを求めればok!この水溶液500mLを上記の水酸化ナトリウム水溶液で滴定したところ,175mLで中和点に達した。 (1) 水酸化ナトリウム水溶液のモル濃度を求めよ。 (2) 希釈前の食酢中の酢酸のモル濃度を求めよ。 (3) 希釈前の食酢の質量パーセント濃度を求めよ。溶液100g中に含まれる溶質の質量(g)をパーセントで表したもの。 (w/w)% =(W/(Ws+W))×100 例題4 濃塩酸は比重119で、372%の塩化水素を含む。



Topics



化学講座 第12回 濃度と密度 私立 国公立大学医学部に入ろう ドットコム
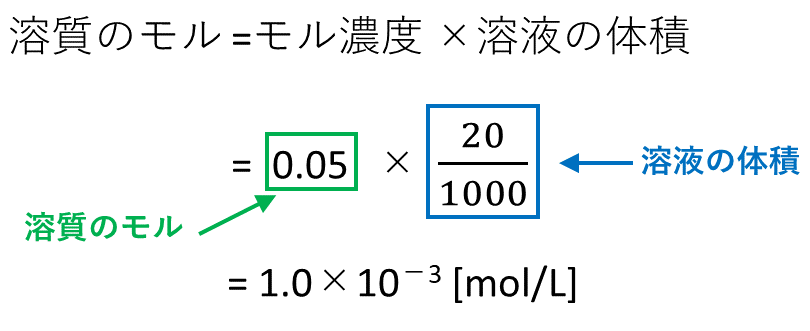
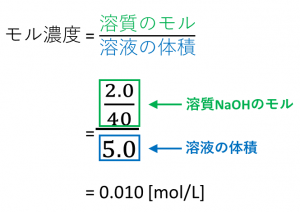
質量パーセント濃度が 22% 、密度が 12g/mL の水酸化ナトリウム水溶液があります。 この水溶液の モル濃度 を求めていきましょう。 さて、どのようにしてモル濃度を求めるか、イメージできますか?Feb 07, 17 · 水溶液は「質量パーセント濃度の求め方」、 状態変化は「水の状態変化」を押さえておけばいいんじゃないかな! 帰国子女(男子) より 18年2月16日 442 AMFeb 09, 17 · 2:モル濃度の計算方法・求め方(公式)と単位 モル濃度とは、先ほど解説した通り、「溶液1Lあたりに、どれだけの溶質molが含まれているか?を示したもの」です。 したがって、モル濃度の公式は、 溶質の物質量mol / 溶液の体積L となります。



溶質を求める




質量 パーセント 濃度 求め 方
一般に,溶液中に含まれる溶質の割合を濃度といい,その表し方には,質量パーセント濃度,モル濃度, 質量モル濃度などがある。濃度に関する出題タイプは,主にⅠ~Ⅶの7つのタイプがある。 例えば,食塩(NaCl)を水(H 2O)に溶かした食塩水を考える。Jan 01, 18 · 濃度を対比して求める方法 10%塩化ナトリウム水溶液を02%塩化ナトリウム水溶液にしているので 10÷02=50 50倍に希釈していることになり、もともとの原液の量は1/50であることがDec 05, · 中1理科 水溶液の濃度の求め方 食塩水 Youtube 中1理科 濃度の計算特訓 混ぜ合わせの濃度計算まで 高校化学 弱酸 酢酸水溶液 の電離度と Ph の求め方 Irohabook 固体の溶解度 化学勉強



Www Jupiterimages Com




質量パーセント濃度の計算問題集 応用編 Menon Network
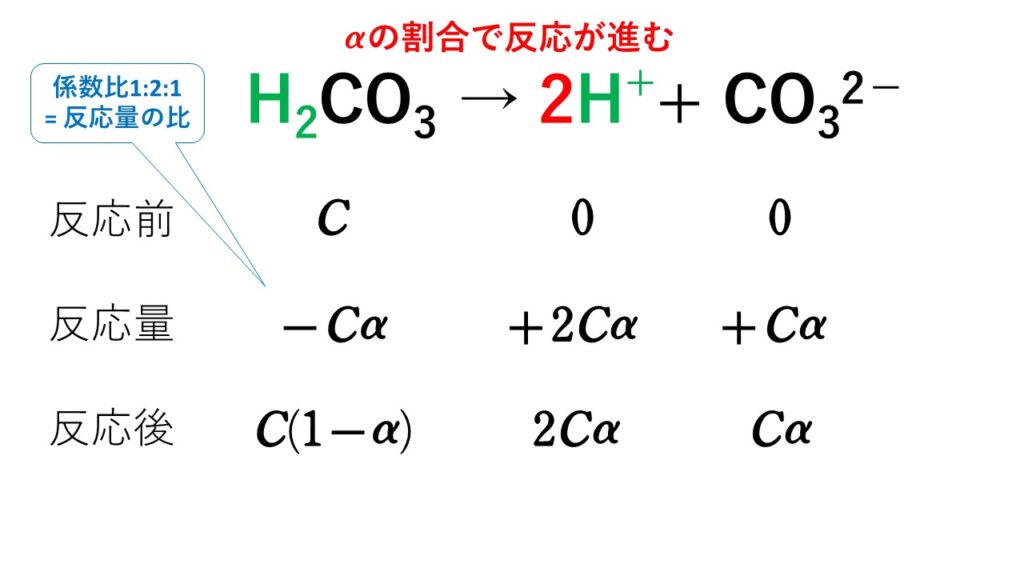
水素イオン濃度を として比例でおくと 1 L=1000 mL中の水素イオンのモル数が水素イオン濃度です。Jan 09, · あとは、 「溶液 × 濃度 = 溶質」 の式で解きます。 3g の水で 3% の食塩水が作りたければ、 12g の食塩 を溶かせばよいんですね。 もしくは、溶液が (x3)g 、 溶質はx g として公式にそのまま突っ込んでも解けますよ👇水溶液の性質 (透明性、均 一性)を説明 できる。 溶液中の様子について 粒子モデルで表現し、考 えを交流する。 ・水溶液の濃度を質量パ ーセント濃度で表すこ とができることを知 り、求め方を理解する。 質量パーセン ト濃度を理解 し、その表し 方



Mol濃度 質量パーセント濃度 質量モル濃度の相互変換の仕方のコツ




モル濃度 Molar Concentration Japaneseclass Jp
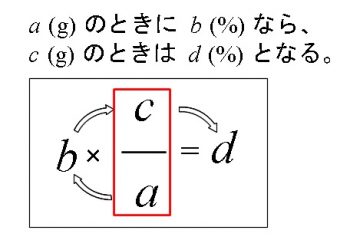
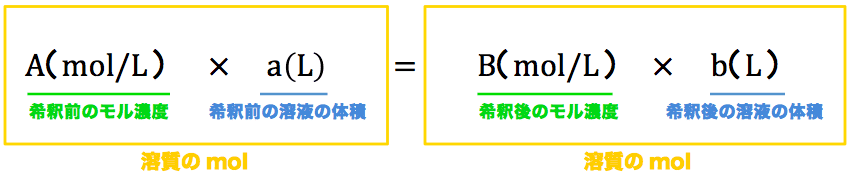
硫酸鉄の水溶液のモル濃度の求め方を教えてください。 店度不明の硫酸鉄 (Fe8O。 水溶液 0mL に少量の希硫酸を加えて水溶液を酸性にした。 これを 0260molL のニクロム酸カリウム Rep 水溶液で滴定すると, 800mL 加えたところで終京に達した。 ①⑬ このFeb 07, 17 · 質量パーセント濃度の求め方を「溶質」と「溶媒」だけで表すと? 質量パーセント濃度の求め方の公式は、 (質量パーセント濃度 % )= (溶質の質量)÷(溶液の質量)×100Oct 07, 05 · 一般に、濃度が異なる溶液を混合したとき、体積はもとの溶液の和にはなりません。 精密な値が必要な場合は、データブックに載っている溶液の密度から計算するとか、実測することが
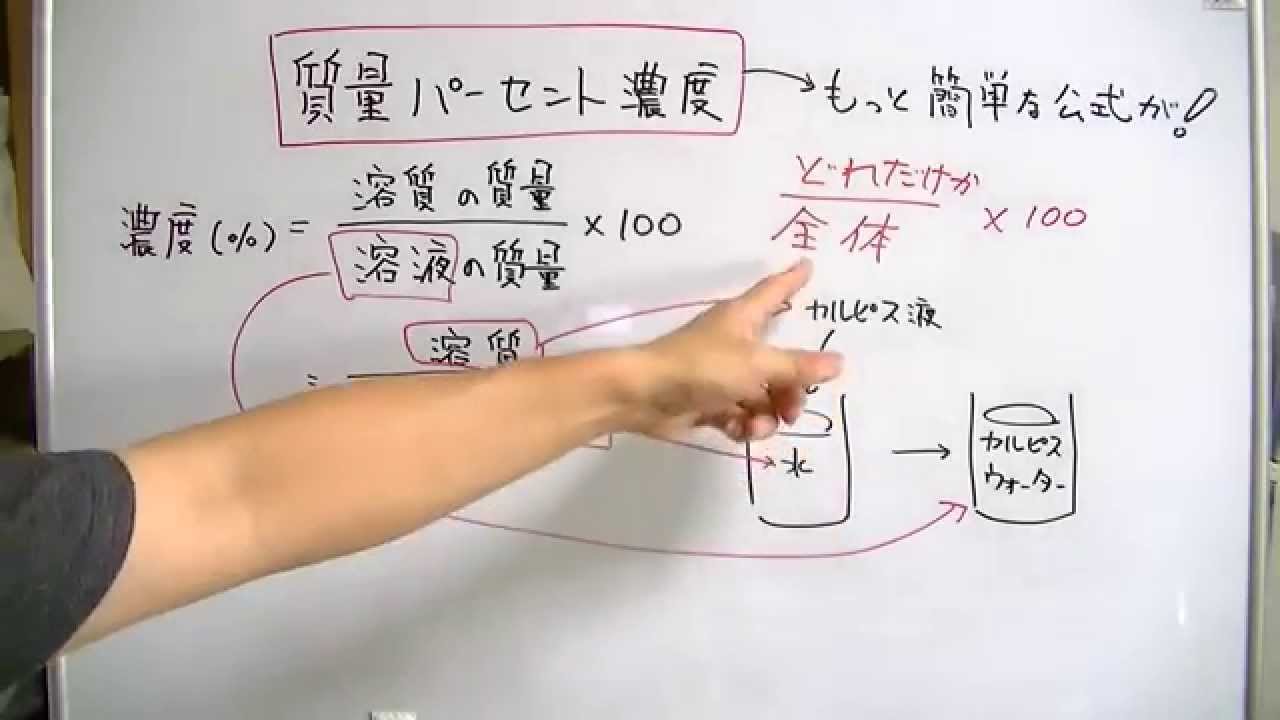



質量パーセント濃度 簡単な公式で覚えよう おときち副塾長 電脳空間学習塾かもん Youtube



濃度の応用
水溶液の濃度(質量パーセント濃度):公式と求め方 水溶液の濃さは溶質の質量を水溶液の質量で割って100をかけて求めます。 溶質の質量÷水溶液の質量×100 この値を質量パーセント濃度ともいいまAug 06, 17 · に当てはまる用語を答えよ。 水は電離して1(h )と2(oh – )を生じる。 h_{2}o ⇄ h^{} oh^{} \ 水の電離度は25℃でα=18×109 と極めて3(大きor小さ)いので、電離している水分子はごく僅かである。 また、(反応式の係数から)h とoh – は等量生じるので、水中のh とoh0630 g を水に溶かして100 mL とした水溶液のモル濃度 モル濃度の求め方を押さえ 〔mol=L〕は る。 0630 1260 £ 1000 100 =500£10¡2〔mol=L〕 答 500£10¡2 mol=L 問2 結果1 より,A 液100 mL を中和するのに要したB 液の体 積〔mL〕は 1 回目;927¡024=903〔mL〕
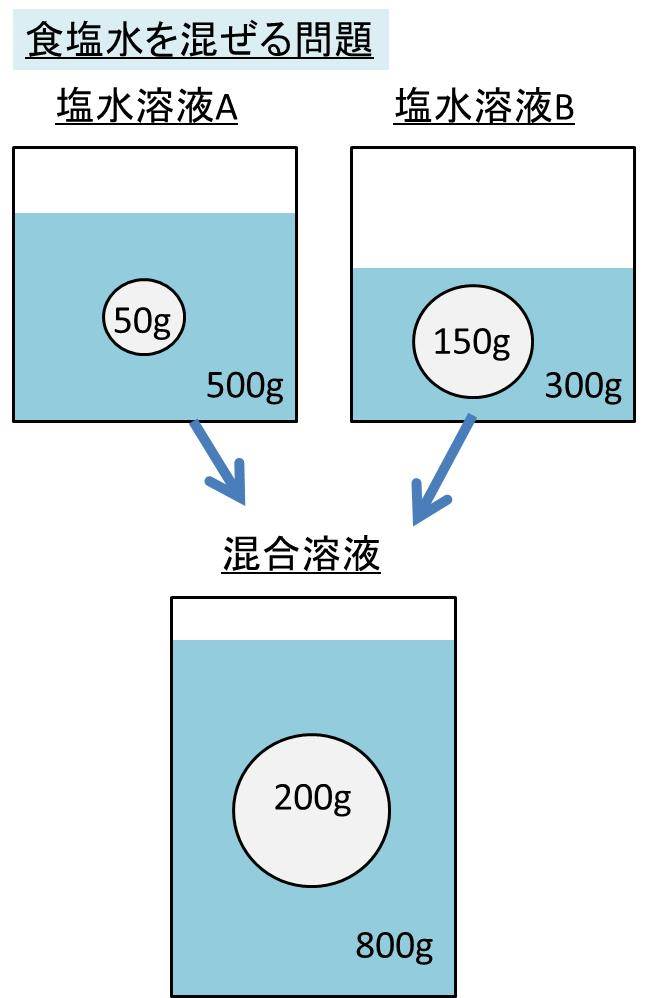



Spi 異なる濃度の食塩水を混ぜる問題の計算方法 濃度算




濃度計算を素早く 化学がちょっとだけ好きな社労士
Feb 08, 15 · このシュウ酸水溶液を10mLとり、濃度不明の水酸化ナトリウム水溶液で滴定したら、50mL加えたところで中和点に達した。シュウ酸水溶液と水酸化ナトリウム水溶液のモル濃度を答えよ。規定度とモル濃度とグラム当量の求め方 規定度とモル濃度とグラム当量の求め方 規定度〔N〕 規定度の名前の種類 規定度Nとは グラム当量とは 規定度Nが意味していること 酸の場合 アルカリの場合 当量eq(equivalent) モルとは モル濃度と規定度の関係 規定度Nと当量eqの換算方法 モル濃度〔mol/L




モル濃度とは 計算 求め方 公式はコレで完璧 質量パーセントとの違いも 高校生向け受験応援メディア 受験のミカタ




高校化学基礎 濃度の計算 練習編 映像授業のtry It トライイット
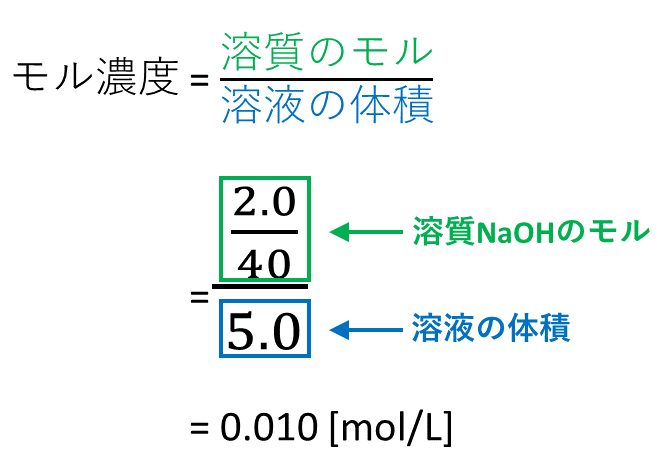



5分でわかる モル濃度と密度 質量パーセント濃度の考え方を図と練習問題付きで徹底解説 サイエンスストック 高校化学をアニメーションで理解する



医療工学科の化学講義 16 溶液濃度計算問題演習 Life Chemistry




モル濃度とは 計算 求め方 公式はコレで完璧 質量パーセントとの違いも 高校生向け受験応援メディア 受験のミカタ
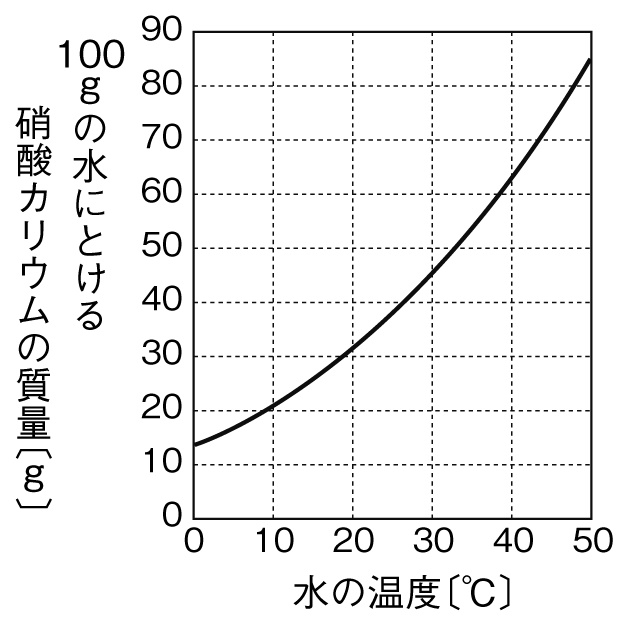



定期テスト対策問題 質量パーセント濃度の計算演習問題 Examee



水溶液と質量パーセント濃度の計算問題 Sciencenote Jp



溶液の質量パーセント濃度の求め方と比重を利用した計算問題




濃度の求め方を教えてください Clear



しわよ で覚える質量パーセント濃度 中学テスト 入試対策ノート




溶液の性質 水和水をもつ固体の溶解度の求め方を教えてください 化学 定期テスト対策サイト




Pdf 濃度の計算ドリル45題 中学理科ポイントまとめと整理 オンラインショップ




中1理科 水溶液と濃度 水溶液の性質と濃度計算 Pikuu




3分でわかる 質量パーセント濃度の求め方の計算公式 Qikeru 学びを楽しくわかりやすく



中1理科 濃度の計算特訓 混ぜ合わせの濃度計算まで Pikuu




溶液の質量パーセント濃度の求め方と比重を利用した計算問題




モノマナビ研究所
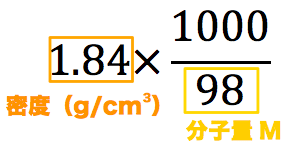



モル濃度計算の解き方 公式 希釈時の濃度 密度や質量パーセント濃度との変換など 化学のグルメ




中1理科 濃度の計算 映像授業のtry It トライイット




食塩水問題 濃度算 の2つの解き方とポイントを図で解説 数学fun



濃度算 混ぜる 高精度計算サイト



1



中1理科 数学 食塩水の問題を動画でマスター 公式の覚え方と濃度の計算 マナブレイン




質量パーセント濃度の計算問題集 基本編 Menon Network




エレガント質量 パーセント 濃度 最高のぬりえ




モル濃度とは 計算 求め方 公式はコレで完璧 質量パーセントとの違いも 高校生向け受験応援メディア 受験のミカタ




質量パーセント濃度の計算問題集 基本編 Menon Network




食塩水問題 濃度算 の2つの解き方とポイントを図で解説 数学fun




1分でわかる質量パーセント濃度の公式や求め方 基本を登録者数95万人人気講師がわかりやすく解説 ページ 4 4 Study Z ドラゴン桜と学ぶwebマガジン




質量パーセント濃度



Mol濃度 質量パーセント濃度 質量モル濃度の相互変換の仕方のコツ




溶液の濃度 無料で使える中学学習プリント
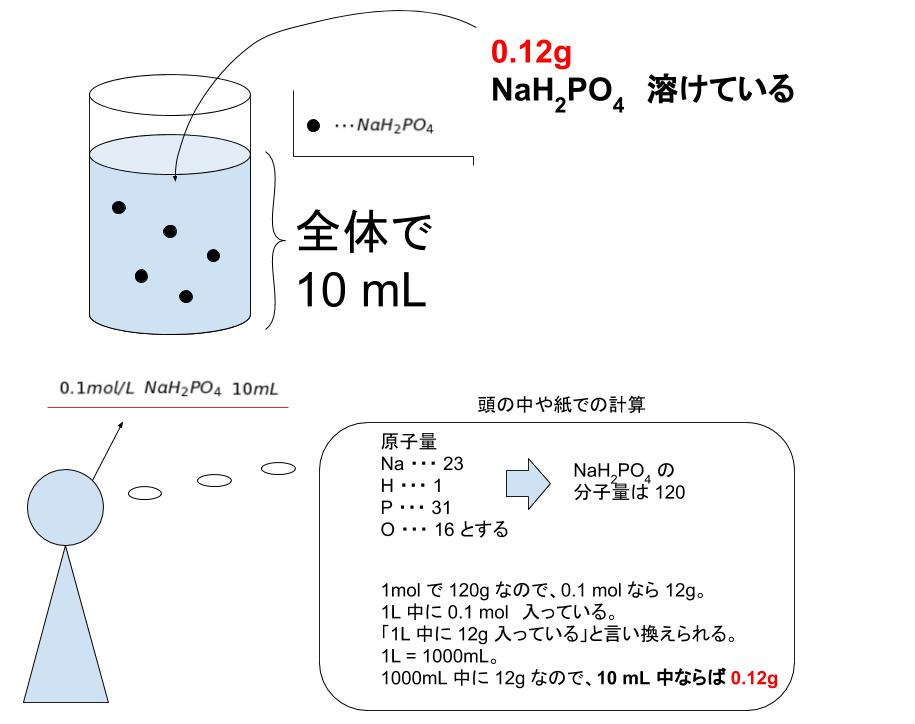



溶液の濃度計算 薬学 これでok




3分でわかる 質量パーセント濃度の求め方の計算公式 Qikeru 学びを楽しくわかりやすく




混合密度の求め方は 混合液の密度 比重 の計算 違う密度 比重を混ぜる ウルトラフリーダム




4 6 溶液の濃度 おのれー Note




高校化学基礎 密度とモル濃度 映像授業のtry It トライイット




質量パーセント濃度の求め方 溶液 溶質 溶媒 の理解が勉強のポイント




溶解度とは 求め方の秘訣 溶解度曲線も図で即理解 計算問題付き 高校生向け受験応援メディア 受験のミカタ




4 6 溶液の濃度 おのれー Note
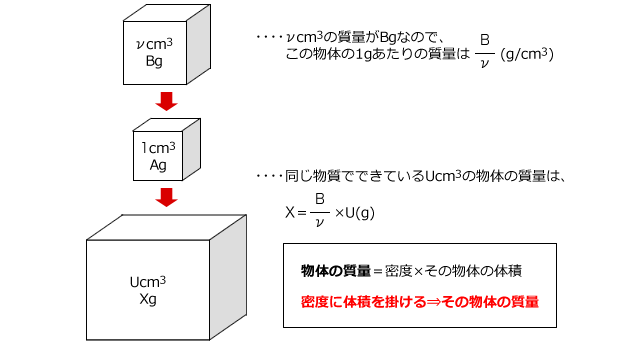



化学講座 第12回 濃度と密度 私立 国公立大学医学部に入ろう ドットコム



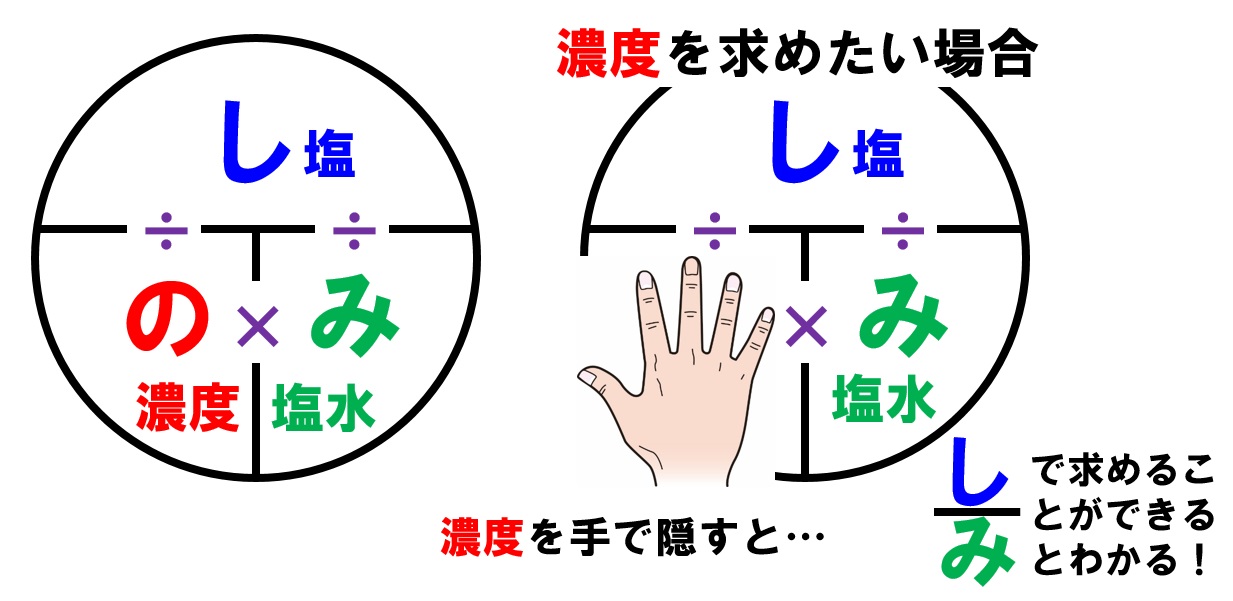
中1理解の 質量パーセント濃度 公式ですが く も わみ Yahoo 知恵袋



基礎化学3 溶液




食塩水の濃度 算数の教え上手 学びの場 Com




濃度のはなし 高校生向け モル濃度と質量モル濃度について 学習内容解説ブログ
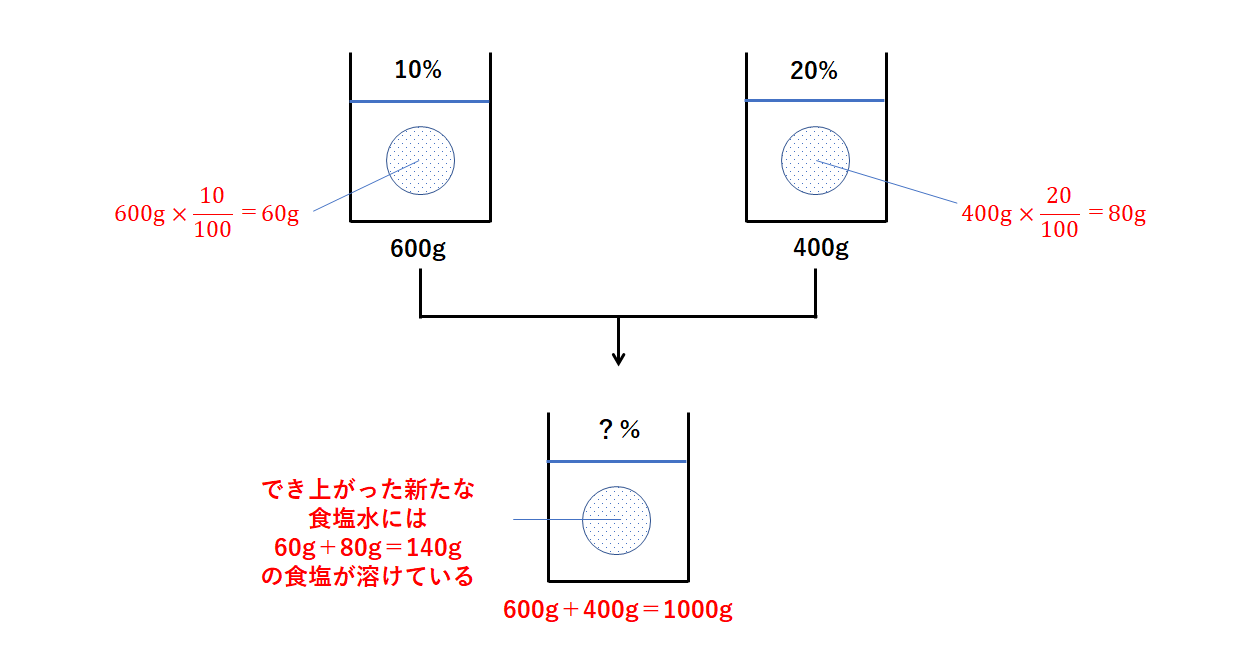



中1化学 水溶液 濃度 中学理科 ポイントまとめと整理




化学基礎 水素イオン濃度の求め方 Youtube
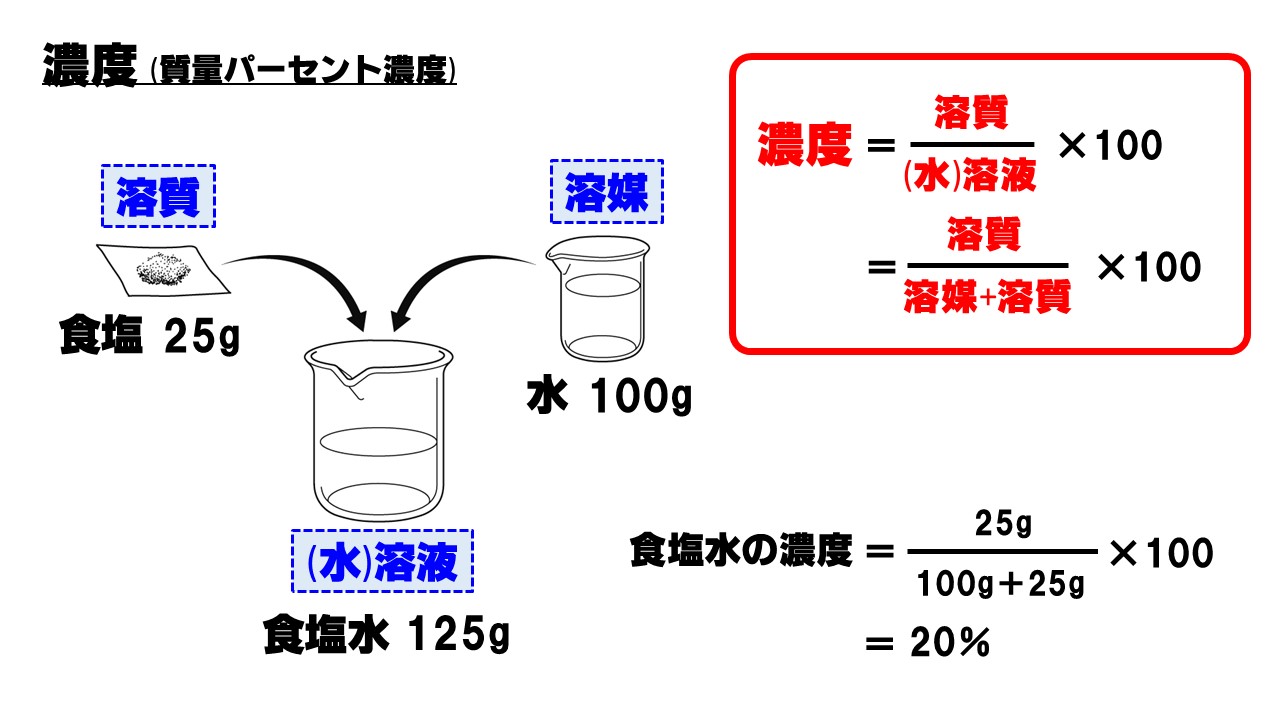



中1理科 濃度 質量パーセント濃度 のポイント Examee




Science 物質 溶解度と濃度 働きアリ




高校化学基礎 密度とモル濃度 映像授業のtry It トライイット



5分でわかる モル濃度と密度 質量パーセント濃度の考え方を図と練習問題付きで徹底解説 サイエンスストック 高校化学をアニメーションで理解する




中1理科 水溶液 濃度の計算が10分で理解できる たけのこ塾 勉強が苦手な中学生のやる気をのばす




中学理科 水溶液の濃度と飽和 溶解度 偏差値40プログラマー




中1理科 濃度の計算特訓 混ぜ合わせの濃度計算まで Pikuu



モル濃度 質量パーセント濃度 質量モル濃度 濃度計算のコツも解説 受験メモ




4 6 溶液の濃度 おのれー Note




手計算 Excel Phとは 計算方法は



モル濃度と密度 質量パーセント濃度の考え方 Vicolla Magazine



基礎化学3 溶液



1




質量パーセント濃度 モル濃度の変換方法を攻略しよう 化学 アイドル好きのホームページ



モル濃度計算の解き方 公式 希釈時の濃度 密度や質量パーセント濃度との変換など 化学のグルメ



1




3分でわかる 質量パーセント濃度の求め方の計算公式 Qikeru 学びを楽しくわかりやすく




3分でわかる 質量パーセント濃度の求め方の計算公式 Qikeru 学びを楽しくわかりやすく




濃度 の計算が苦手な方へ 元研究員がわかりやすく解説 Study Z ドラゴン桜と学ぶwebマガジン




高校理論化学 食酢中の酢酸のモル濃度と質量パーセント濃度 受験の月




浸透圧とは 実験 公式 理系ラボ




高校理論化学 溶液の濃度と調製 質量パーセント濃度 密度とモル濃度の単位換算 受験の月



基礎化学3 溶液




濃度 の計算が苦手な方へ 元研究員がわかりやすく解説 ページ 3 4 Study Z ドラゴン桜と学ぶwebマガジン




3分でわかる 質量パーセント濃度の求め方の計算公式 Qikeru 学びを楽しくわかりやすく




この問題の一つ目の モル濃度を求める計算の部分で 1 1 11と 1 1000が何を Clear




質量パーセント濃度の計算問題集 基本編 Menon Network




質量パーセント濃度の求め方とモル濃度の違い



5分でわかる 水のイオン積とphとpohの計算法 練習問題付き サイエンスストック 高校化学をアニメーションで理解する
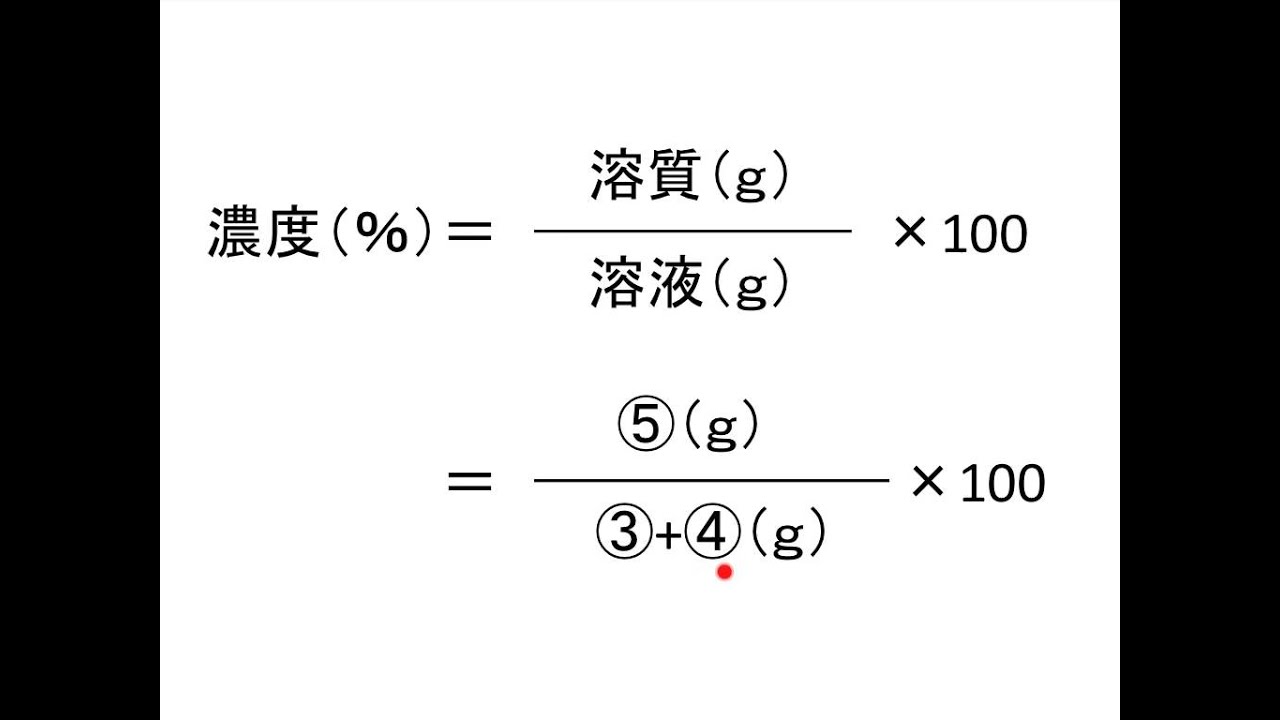



濃度の求め方 絵で覚えよう Youtube
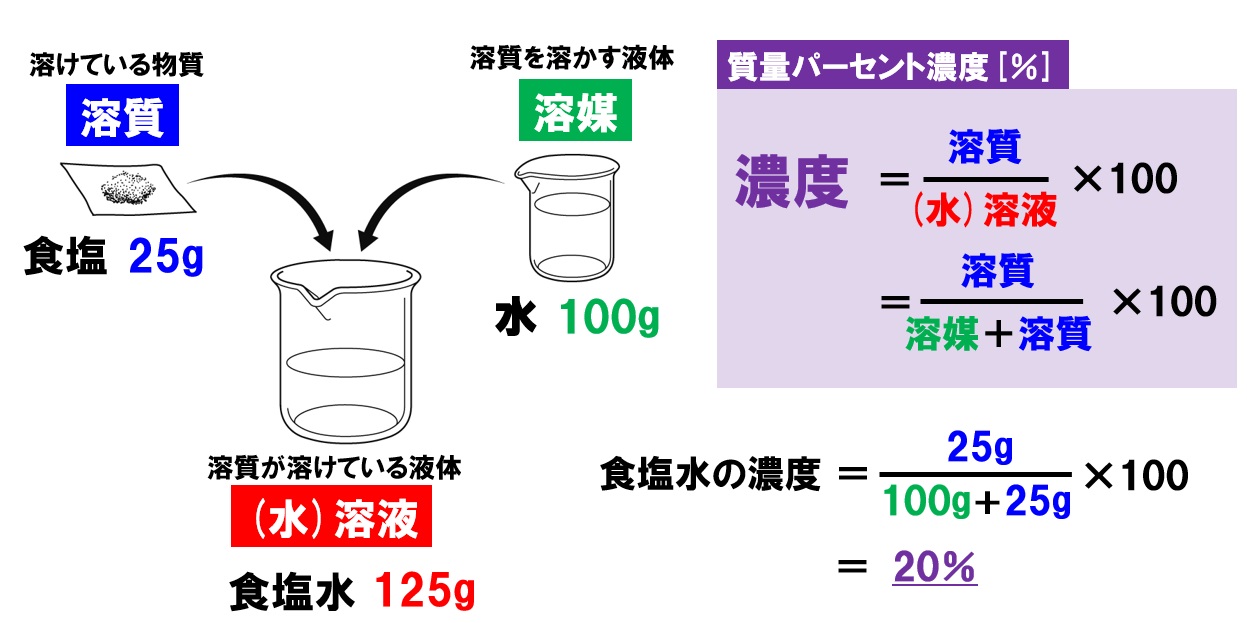



中1理科 水溶液と濃度 水溶液の性質と濃度計算 Pikuu




برچسب 質量パーセント濃度 در توییتر




高校化学 質量モル濃度 映像授業のtry It トライイット




中和滴定による濃度の決定について計算式の意味がわかりません 理科 苦手解決q A 進研ゼミ高校講座



受験化学 9 溶解度の計算1 みかみの参考書ブログ




理科 中1 27 質量パーセント濃度 Youtube



Q Tbn And9gcsld6 Ormlgxpohngzjvdyjr Xcxlaq5ug4wfnwldtuxbkqfgqd Usqp Cau


